Besonderheiten der Gesundsheitsforschung bei Anträgen zur steuerlichen Forschungszulage
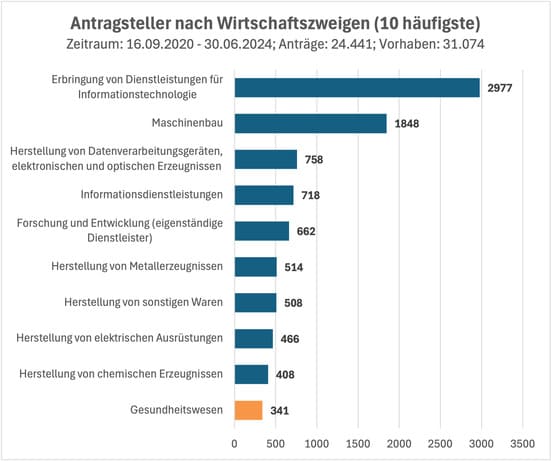
Die Gesundheitsforschung, Medizintechnik und Pharma gehören mit 341 beantragten Vorhaben zu den 10 häufigsten Wirtschaftszweigen der Antragsteller. Damit wurde die steuerliche Forschungszulage ein zentraler Finanzierungsbaustein für Entwicklungsvorhaben.
Jedoch stellt die Gesundheitsforschung banchenspezifischen Anforderungen an die Antragstellung. Die nachfolgenden Erläuterungen orientieren sich an dem Prüfleitfaden der Bescheinigungsstellung und beziehen die Erfahrungen aus unserer täglichen Beratungsarbeit mit ein.
Die Gesundheitsforschung umfasst alle Aspekte der Forschung, Entwicklung und Anwendung von Technologien und wissenschaftlichen Erkenntnissen zusammen, die direkt auf die Verbesserung der menschlichen Gesundheit abzielen.
Die Gesundheitsforschung ist geprägt von einem breiten Spektrum an Untersuchungsgebieten, die von der Erforschung neuer Behandlungsmethoden bis zur Prävention und Kontrolle von Krankheiten reichen. Forschungsinitiativen in der Gesundheitsbranche sind dabei oft multidisziplinär und integrieren Erkenntnisse aus verschiedenen Wissenschaftszweigen, um umfassende Lösungen für komplexe Gesundheitsprobleme zu entwickeln.
Schlüsselbereiche der Gesundheitsforschung
Bescheinigungsfähige Bereiche
In der Gesundheitsforschung werden ständig neue Methoden und Technologien entwickelt, um die Prävention, Diagnose und Behandlung von Krankheiten zu verbessern. Einige der Schlüsselbereiche, die heute im Fokus der Forschung stehen, umfassen:
- Patientenversorgung
- Pharmaforschung / Arzneimittel und Impfstoffe
- Medizinprodukte
- In-Vitro-Diagnostika
- Digitale Gesundheitsanwendungen
Diese Schlüsselbereiche stellen keine abschließende Liste möglicher Themen im Rahmen der steuerliche Forschungszulage dar.
Nicht bescheinigungsfähige Tätigkeiten
Folgende Tätigkeiten sind i. d. R. nicht bescheinigungsfähig:
- reine fachmedizinische Versorgung zur routinemäßigen Vorsorge und Untersuchung von Patienten unter Anwendung medizinischer Fachkenntnisse
- Klinische Studien der Phase IIIb, da in dieser die Zulassungsunterlagen erstellt werden
- Klinische Studien der Phase IV
- Klinische Bewertung von Medizinprodukten
- Leistungsbewertung von In-Vitro-Diagnostika
- Alle regulatorischen/administrativen Tätigkeiten im Rahmen der Zulassung und Aufnahme ins DiGA-Verzeichnis
- Beratungstätigkeiten (z.B. im Rahmen der gesetzlichen Anforderungen)
Pharmaforschung, Arzneimittel und Impfstoffe
Die Verfahrensschritte bis zur Zulassung eines Arzneimittels oder Impfstoffes lassen sich klassischerweise in folgende Schritte gliedern:
- Präklinik
- Klinische Studien (Phasen 0 bis IV)
- Prüfung / Zulassung durch die Behörden In Phase IIIb werden die Zulassungsunterlagen erstellt.
Daher sind Arbeitspakete in einem Vorhaben, die eindeutig in Phase IIIb fallen, nicht bescheinigungsfähig.
Neben den Studien, die vor der Zulassung stattfinden, gibt es weitere Studien im klinischen Kontext, die nach erfolgter Zulassung durchgeführt werden (Klinische Studien Phase IV). Die folgenden Studientypen der Phase IV sind grundsätzlich nicht bescheinigungsfähig, können jedoch unter bestimmten Voraussetzungen FuE zugeordnet werden und somit bescheinigungsfähig sein:
- PAES (Post Authorization Efficacy Study)
- PASS (Post Authorization Safety Study)
- Off-Label-Use Studie
Im Pharmabereich generell nicht bescheinigungsfähig sind folgende Studientypen:
- Anwendungsbeobachtung (AWB), nicht interventionell
- Fall-Kontroll-Studie, nicht interventionell
- Kohortenstudie, nicht interventionell
- Registerstudie, nicht interventionell
- Head-to-Head-Studie, interventionell
Medizinprodukte
Beispiele für Forschungs- und Entwicklungsaktivitäten (F&E) in der Medizintechnik
In der Medinzintechnik werden ständig neue Methoden und Technologien entwickelt. Einige der Schlüsselbereiche, die heute im Fokus der Forschung stehen:
- Entwicklung neuer Implantate
- Entwicklung neuer Algorithmen für die Analyse von medizinischen Daten
- Neue Anwendungsszenarien von VR/AR-Technologie in der medizinischen Versorgung
- Entwicklung neuer Marker für die Diagnostik
- Erforschung neuer Materialien und Oberflächenstrukturen für den medizinischen Einsatz
- Entwicklung miniaturisierter Sensoren für die Diagnostik
Künstliche Intelligenz als Megatrend in der Medizintechnik
Um förderfähige FuE-Aktivitäten handelt es sich auch, wenn beispielsweise neue effizientere Algorithmen auf Basis neuer Technologien und wissenschaftlicher Erkenntnisse, wie z. B. im Bereich Künstlicher Intelligenz, entwickelt werden. KI wird bereits in einer Vielzahl von medizinischen Anwendungen eingesetzt:
- Diagnostik: KI-gestützte Systeme können bei der Analyse von Bilddaten, wie Röntgen-, CT- und MRT-Bildern, helfen, Krankheiten frühzeitig zu erkennen.
- Behandlung: KI-gestützte Systeme können bei der Planung und Durchführung von Operationen helfen, die Sicherheit und Effizienz der Behandlung zu verbessern.
- Prävention: KI-gestützte Systeme können bei der Entwicklung von personalisierten Präventionsstrategien helfen, die Wahrscheinlichkeit von Krankheiten zu verringern.
Nicht bescheinigungsfähige Kosten
Folgende Tätigkeiten sind i. d. R. nicht bescheinigungsfähig:
- reine fachmedizinische Versorgung zur routinemäßigen Vorsorge und Untersuchung von Patienten unter Anwendung medizinischer Fachkenntnisse
- Klinische Studien der Phase IIIb, da in dieser die Zulassungsunterlagen erstellt werden
- Klinische Studien der Phase IV
- Klinische Bewertung von Medizinprodukten
- Leistungsbewertung von In-Vitro-Diagnostika
- Alle regulatorischen/ administrativen Tätigkeiten im Rahmen der Zulassung und Aufnahme ins DiGA-Verzeichnis
- Beratungstätigkeiten (z.B. im Rahmen der gesetzlichen Anforderungen)
In-Vitro-Diagnostika
Die Entwicklung von IVD verläuft ähnlich wie die von Medizinprodukten (s. oben). Für IVD steht am Ende der Entwicklung die Leistungsbewertung, die der klinischen Bewertung bei den Medizinprodukten Klasse I-IIb entspricht. Analog hierzu ist die Leistungsbewertung Teil der technischen Dokumentation, d.h. Daten werden zusammengestellt, analysiert und bewertet. Somit hat diese Phase das alleinige Ziel der Zulassung. Diese Tätigkeiten sind nicht bescheinigungsfähig.
Nutzen Sie öffentliche Fördermittel und geben Ihrem Unternehmen einen Wachstumsschub!
Hohe Zuschüsse und Zulagen schaffen die notwendigen unternehmerischen Freiräume.
Schöpfen Sie Ihre Förderansprüche aus, mit unseren regelmäßigen Veröffentlichung möchten wir Beiträge für erfolgreiche Fördermittelanträge leisten.

Helmut Haimerl
Helmut Haimerl ist Geschäftsführer der Steinbeis Technologie- und Innovationsberatung GmbH. Er gilt als einer der führenden Experten für Technologieförderung in Deutschland. Sein Wissen in Theorie und Praxis macht ihn zu einem gefragten Gastautor. Ein besonderes Augenmerk legt er auf das systematische Vorgehen, um den innovativen Kern der Projekte im Dialog mit den Kunden herauszuarbeiten. Sein Ziel ist die Optimierung von Förderanträgen und das Ausschöpfen von Gestaltungsmöglichkeiten.
Neueste Kommentare